Seitonorika 2019-1,2019年11月2日受理,ダウンロードPdf
辻村秀信1,2)、赤川裕美2)、城明日香*3)、谷本朔弥*3)、森中敏行3)、普後一2)
1)生徒の理科研究所、〒623-0342 京都府綾部市金河内町奥地22
2)東京農工大学農学部、〒183-8509 東京都府中市幸町3-5-8
3)大阪教育大学附属高等学校天王寺校舎、〒543-0054 大阪府大阪市天王寺区南河堀町4-88
*:生徒
責任著者:辻村秀信、tsujmr@seitonorika.jp、生徒の理科研究所
要旨:高校生の理科研究のためのショウジョウバエ飼育法と麻酔法を紹介する。①ハエの取り寄せ方、②エサビンの作り方、③系統保存ハエのエサ替えのしかた、④実験用ハエビンの作り方、⑤ビン洗い・栓洗い、⑥飼育環境、⑦ハエを上手に育てるこつ、⑧麻酔のかけ方、⑨実験機器・薬品の購入、⑩ハエの飼育と麻酔に関する小研究テーマ。この論文で述べる方法は高校におけるショウジョウバエの安定的系統維持と効率的・実戦的飼育を可能とし、生徒理科研究の発展に貢献するに違いない。
類別:方法論文 分野:生物 キーワード:ショウジョウバエ、飼育法、麻酔法
はじめに
ショウジョウバエ(図1A)は様々な生物実験のできる便利な実験動物である。しかし、そのことが一般に理解されるようになったのは比較的最近である。ショウジョウバエは、長年、理科教科書で遺伝法則の説明に用いられてきた結果、「遺伝実験に用いられる特殊なハエ」と見なされてきた。しかしショウジョウバエは今日、マウス、ゼブラフィッシュ、線虫とともにゲノム研究のもっともすすんだ重要な実験動物となっており、このハエを用いた様々な生物学研究が盛んに展開されている。このことは、ショウジョウバエ研究に与えられたノーベル賞にもよく表れている。1995年のノーベル医学生理学賞は胚発生にはたらく遺伝子の解明(岡田, 1996; 谷村, 1996; ゲーリング, 2002)に、2011年のノーベル医学生理学賞は自然免疫のしくみの解明(中西, 2011; 倉田, 2014)に、2017年のノーベル医学生理学賞は概日リズムの分子機構の解明(中西, 2017;谷村, 1996)に贈られた。また、この他にも神経発生の分子機構(野瀬, 1996)や、学習の分子機構(谷村, 1996; 松本・佐藤,2009)、配偶行動の神経機構(山元, 2012)、からだの左右非対称性の分子機構(松野)、細胞死の分子機構(三浦, 2012)の解明に重要な成果を挙げてきた。最近では細胞競合と組織恒常性維持の分子機構(谷口・井垣, 2017)、行動と脳機能の神経機構(谷村, 1996; 上川内, 2014; 伊藤, 2017)、老化の分子機構(鍋島, 1998; 千原・三浦, 2014; 三井 他, 2014)、栄養と代謝調節の分子機構(相垣, 2016)、およびショウジョウバエを用いたヒト難病の研究(山口, 2016)などが盛んに行われている。このような研究の発展は、高校生徒の行う理科研究に新しいショウジョウバエ研究の可能性を提起している。すなわち、ショウジョウバエを用いた発生、免疫、組織恒常性維持、脳神経、行動、栄養と代謝調節、老化といった高度生命機能の研究の可能性が開けている。
ショウジョウバエ研究には様々な変異体の継代飼育が必須である。なぜなら、ショウジョウバエではこれまでの遺伝子・ゲノム研究の成果として大量の変異系統が系統保存センターに飼育・保存されており、そこから取り寄せたいくつかの変異系統を掛け合わせて研究目的に合った遺伝子型のハエを作成し、そのハエについて様々な解析を行うのがショウジョウバエ研究のすぐれた特徴だからである。また、高度生命機能の研究では形質の定量的解析を行うことが多い。そのためには、実験室におけるハエの安定的で効率的な飼育法の確立が必須である。しかし、これまでに発表された中学・高校教育のためのショウジョバエ飼育法(前川, 1999; Akasaka; 宮内; 布山; Jfly discussion, 1995)は、エサの組成だけを記載したり、遺伝法則の確認実験のための一時的飼育法であったりで、大学の専門研究室の飼育法と比べて、安定的飼育という点でも、効率的・実戦的飼育という点でも高度生命機能の研究には不十分である。
そこで本論文では、大学研究室の方法(辻村・赤川, 2014; Sullivan 他, 2000)をもとに現実の高校現場を考慮しつつ開発した生徒理科研究のためのショウジョウバエ飼育法と麻酔法を紹介する。また、研究を進める中で遭遇する諸問題を解決するためのノウハウを紹介する。本論文は、生徒理科研究におけるショウジョウバエを用いたさまざまな生物機能研究の展開に貢献するに違いない。

1.ハエの取り寄せ方
実験に用いるショウジョウバエは、系統保存センターから取り寄せる。野生型だけを用いる場合は野外から採取して実験に用いることもできるが、勧められない。野外から採取したショウジョウバエにはダニが寄生していたり、ウイルスや細菌が感染していたりする可能性があるからである。また、転移因子を多数持っていて、飼育しているうちに予期せぬ突然変異が生じたりする場合もある。
ショウジョウバエの系統保存は世界的には2つの主要なセンターで行われている。その一つが日本に存在する京都工芸繊維大学「ショウジョウバエ遺伝資源研究部門京都ストックセンター」である(図1B)。このセンターは、ショウジョウバエの突然変異系統、遺伝子組換系統を多数保存飼育し、日本および世界のショウジョウバエ研究者に配布している。
高校・中学における生徒理科研究にはショウジョウバエの野生型や、さまざまな突然変異系統(塩基置換、欠失、転移、欠失、重複)、染色体異常系統を利用することができる。しかし、遺伝子組み換え系統は取り寄せることも使用することもできない。遺伝子組み換え生物の飼育やそれを用いた研究は「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)」および関連省令により厳しく制限されているからである。
【ハエの申し込みと料金】
研究者向けには所定の料金が設定されているが、小学・中学・高校教育で使用する場合は郵送料のみで配布を受けることができる。申込はホームページの系統申込みフォームからではなく、電話、FAX、またはホームページ「お問い合わせ」フォームでセンターに直接申し込む。センターからはハエは小さい管ビンにいれて郵送されてくる。なお、センターは適切な実験用・教育用変異系統の紹介などの相談にも応じてくれるので活用するとよい。
連絡先:ショウジョウバエ遺伝資源部門京都ストックセンター(Drosophila Genetic Resource Center (DGRC))
住所:〒616-8354 京都市右京区嵯峨一本木町1 京都工芸繊維大学嵯峨キャンパス
電話番号:075-873-2660 FAX番号:075-861-0881
ホームページアドレス:
http://www.dgrc.kit.ac.jp/japanese/
ホームページ「お問い合わせ」フォーム:http://www.dgrc.kit.ac.jp/contact/contact.html
2.エサビンの作り方
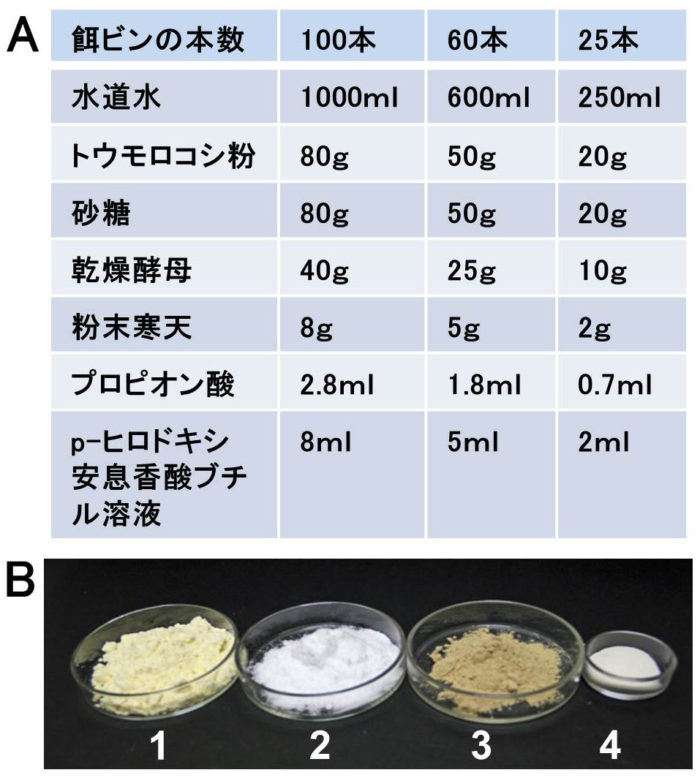
ショウジョウバエは直径3cmの培養試験管中で、トウモロコシ粉、砂糖、乾燥酵母を寒天と水で固めたエサを用いて飼育する(図1C)。
【材料・薬品】(図2,図3)
トウモロコシ粉(食品材料、コーンフラワーまたはコーンミール)、砂糖(食品材料、白砂糖)、乾燥酵母(食品材料、パン酵母またはビール酵母)、粉末寒天(食品材料、精製寒天でもよい)、水道水。防腐剤としてプロピオン酸(薬品)、p-ヒロドキシ安息香酸ブチル(薬品、p-ヒロドキシ安息香酸メチルでもよい)、エタノール(薬品)。

【器具】(図2)
つくるエサビンの数だけ準備するもの
培養用試験管(理化学器具、外径30mm×長さ120mm、平底、ガラス植物培養試験管またはプラスチック遠沈管)、スポンジ栓(一般器具、試験管の口径にあうもの(約32-35mm径)、厚さ40mmのスポンジシートをカットして作ることもできる)
エサビンつくりのための器具
ガスコンロ(一般機器)、雪ひら鍋(一般器具、1ℓ)、鍋(一般器具、3ℓ)、ヘラ(一般器具)、調理用はかり(一般機器、クッキングスケール、0.5g単位)、計量カップ(一般器具、200mℓと1ℓ、メモリ付)、薬さじ(理化学器具)、駒込ピペット(理化学器具、2mℓ、メモリ付、2本)、種落とし(一般器具、1ℓまたは3ℓ用、別名チャッキリ、太口はだめ、スタンド付は便利)、ステンレス試験管立て(理化学器具、φ30mm用。10~20本用)、キッチンペーパー(一般器具、または綿布)、金網(一般器具、キッチンペーパーを押さえることができれば何でもよい)、空き缶(一般器具、種落とし置きに使えるものなら何でもよい)、プラスチック50ml遠沈管(理化学器具)
【p-ヒロドキシ安息香酸ブチル溶液】
エタノール100mlにp-ヒロドキシ安息香酸ブチル 15gを溶かした溶液、あらかじめ作っておく。溶液は揮発するので密栓(ネジふた)のできる容器(プラスチック50ml遠沈管または試薬ビン)に入れ、栓はしっかり締める。

【エサビンつくりの手順】(図3,図4)
①培養用試験管を試験管立てにセットする(図2A)。または10本程度の試験管を輪ゴムで縛って立てる。
②トウモロコシ粉、砂糖、乾燥酵母、粉末寒天を量り、鍋に入れ、均一に混ぜる(図3,図4(1))。
③ダマにならないようヘラで混ぜながら、使用する水道水の20%程度の水を少しずつ加え、材料をペースト状にする(図4(2))。
④さらに、水道水でペーストを少しずつのばしながら、残りの水道水全てを入れ、液状にする(図4(3))。(水の量は図3A表の量の20-30%増しにする。エサつくり中の水の蒸発に対応するためである。)
⑤鍋をガスコンロ中火(または強火)にかけ、焦がさないようにヘラで鍋底を擦るように混ぜながら強く沸騰するまで熱する(図4(4))。
⑥一旦沸騰後は弱火にして弱く沸騰させながら10分間煮る(図4(5))。
⑦あらかじめ⑨で使用する種落としを熱湯にいれて温めておく。熱湯は危険なので安全な取り扱い方を工夫する。
⑧火を止めてから、p-ヒロドキシ安息香酸ブチル溶液とプロピオン酸を駒込ピペットで加え、10回程度ヘラでよく混ぜて均一にする(図4(6))。
⑨エサを鍋から種落としに移し、種落としを用いて試験管に約1.5cmの深さになるように分注する(図4(7-8))。種落としが熱い場合は、軍手をはいて作業を行う。
⑩試験管の縁に付着した餌をティッシュペーパーで拭き取る。
⑪試験管の口をキッチンペーパーまたは綿布で覆い、金網等で重しをしてハエの侵入を防止する(図4(10))。そのまま一晩置き水蒸気を飛ばす。
⑫翌日、スポンジ栓をする(図4(11))。
⑬エサビンは乾燥を防ぐため大きなビニール袋に入れ、密閉して保存する。保存は1週間以内なら室温(25℃以下)で、それ以上の期間の場合は4℃で保存する。
⑭エサつくりに用いた器具を洗う。
3.系統保存ハエのエサ替えのしかた
系統保存センターから取り寄せたハエは、まず、研究室の系統保存ハエとして継代飼育を行い、実験にはその系統保存ハエから別に実験用ハエビンを作成し、用いる。ここではまず系統保存ハエのエサ替えのしかたを述べる。
ショウジョウバエのエサ替えは、ハエを新しいエサビンに移すことにより行う。新しいエサびんには止まり木として、ろ紙を折った短冊をエサに差し込んでおく。この新エサビンに古いエサビンのハエを移す。この時、麻酔はかけない。
ろ紙の止まり木を入れると、餌にハエがくっつかない、湿度調節に役立つなどの理由でハエの生育がよくなる。
ハエを逃がさないためにはエサ替えをする前に動作の習熟が重要である。何回か手順を練習してから実際のエサ替えを行う。
【器具】(図5)
クッションマット(一般器具、スポンジシートまたは発泡ポリエチレンお風呂マットを約10㎝×10㎝に切断したもの、厚さ1cm以上)、濾紙(理化学器具、厚いろ紙、2㎝×5㎝に切っておく)、プラスチック製ロート(理化学器具)、歯科用ピンセット(理化学器具)

【ハエ捨てビン】
70%アルコールを5cmの深さまで入れた500ml使用済み試薬ビンにプラスチック製ロートを差して使う。

【手順】(図6)
①飼育中のハエビンと新しいエサビンを用意する(図6(1))。
②縦に二つ折りした濾紙をピンセットで新エサビンのエサ表面にさし込み、ハエの止まり木とする(図5F)。止まり木を入れなくても飼育できるが、入れたほうがよく殖える。
③まず新しいエサビンの栓をとる(図6(2-4))。
④飼育中のハエビンの栓をすこし出して抜きやすくする(図6(5))。
⑤飼育中のハエビンをたたいて管壁からハエをはたき落とす。ハエビンを横向きにし、ハエビンの栓を取り、すぐにその口を新しいエサビンの口に合わせる(図6(6-8))。ハエビンと新エサビンを連結したまま立て向きにし、スポンジマットに軽く打ちつけて、ハエを新しいエサビンに落とす(図6(9))。
⑥連結したハエビンと新エサビンを横向きにし、直ちに新エサビンに栓をし、次に古いハエビンにも栓をする(図6(10-14))。
⑦古いハエビンのラベルを新エサビンに張り替える。ラベルはビニールテープを使用するとよい(図6(15-17))。
⑧ハエは25℃または18℃の中温恒温器(または人工気象器)に入れて飼育する(図7C)。新しいエサビンに入れたハエは、翌日または2日後から継続的に産卵を行う。
⑨親ハエは入れたままにしない。25℃飼育の場合は1週間後に親ハエをハエ捨てビンにすてる。18℃飼育の場合は2週間後にすてる。次世代のハエは、25℃飼育の場合はエサ替え後10日から成虫になる。18℃飼育の場合は20日から成虫になる。
⑩使用済みのハエビンは速やかに洗う。使用済みのハエビンを長く放置するとダニが増えることがある。
*冷蔵保存したエサビンは室温に戻してから使用する。
*口径の異なるエサビンにハエを移すときは、新しいエサビンに小ロートを置き、そのロート中にハエビンを逆さにしてつなぎ、つないだままクッションシートに軽くたたきつけて、ハエを新エサビンに落とし入れる。
*1系統につき2本のエサビンを用いて飼育する。 25℃飼育ではでは産卵後1週間で蛹になり、2週間で産卵可能な成虫ハエとなる。 18℃では産卵後2週間で蛹となり、4週間で産卵可能な成虫ハエとなる。そこで、25℃では1本ずつ1週間間隔で交互にエサ替えを行う。18℃では1本ずつ2週間間隔で交互にエサ替えを行なう。弱い系統のハエは1系統につき4本または8本のエサビンを用いて飼育し、半数ずつ1週間または2週間間隔で交互にエサ替えを行う。
*新しいエサビンに親ハエを入れる時は、40頭程度が適当である。親ハエが少数の時は、下記の「ハエを上手に育てるコツ」を参考に酵母をいれたエサビンを使う、あるいは、エサ替えを1-2日間遅らして羽化成虫をふやしてからエサ替えを行うなどの工夫をする。
*親ハエの数が多すぎる時は、新しいエサビンに移した後、25℃飼育の場合は3-4日後に、18℃飼育の場合は1週間後に親ハエを捨てて、産卵数を減らす。
*長期間飼っていると殖え方の悪いビンが出現することがある。ハエビン中に雑菌やカビが繁殖しビン内環境が悪化したからである。この時はそのハエビンはすてて、よく殖えているハエビンから殖やすようにする。この他にハエが急に殖えなくなったり、急によく殖えるようになったりする場合は、本来のものとは異なる遺伝子型のハエが殖えている場合があるので注意する。
4.実験用ハエビンの作り方
①実験は、系統保存ビンとは別に実験用ハエビンを作成し、そのハエを用いて行う。
②実験用ハエビンを新たに作るためには、系統保存用に産卵させた後の親ハエを捨てずに、下記の「上手に育てるコツ」により作成した練り酵母入りの新しいエサビンに移し、25℃で数日間産卵させ、実験用ハエビンとする。その後さらに新しいエサビンに移して殖やすことを必要な回数だけ繰り返す。
③別の方法としては、エサ替えを終えた古いエサビンをすぐに洗わずに数日間保存し、そこから新たに出てくる成虫ハエを練り酵母入りの新しいエサビンに移して実験用ハエビンとする。
④必要数の実験用ハエビンをつくり、実験はこの実験用ハエビンで殖やしたハエをもちいて行う。
5.飼育環境
飼育中は温度、湿度、日長管理が重要である。
【器具】小型中温恒温器(理化学機器、クールインキュベータ(i-CUBEまたはCN-25C、人工気象器でもよい)、24時間タイマー(一般機器)、LEDランプ(一般器具)

①温度管理:新しいエサビンに移し変えたハエは18℃または25℃で飼育する。系統保存には25℃飼育または18℃飼育を行い、実験用ハエは25℃飼育を行う。ハエの飼育は小型中温恒温器または人工気象器で行う。22℃で飼育する場合もあるが、その場合はエサ替えの周期が10日間間隔になる。
②湿度管理:湿度を高く60%以上に保つことが重要である。乾燥状態ではエサが乾燥するため成育が悪くなる。人工気象器を用いるときには飼育ビンと水を入れたビーカーをともに大きなビニール袋に入れ、袋の口を折り返して(密閉はしない)、湿度が下がらないようにしながら飼育する(図7A,B)。小型恒温器を用いるときは、水を入れたビーカーを直接恒温器内にいれて器内湿度が下がらないようにする。実験室内に直接おいて飼育するときも、飼育ビンと水を入れたビーカーをともに大きなビニール袋に入れて飼育する。
③明暗管理:24時間タイマーと小型LEDランプをもちいて12時間明・12時間暗の明暗調節を行う。ハエの成長は明暗周期の影響を受ける。
6.実験ハエを上手に育てるこつ
ハエを継代飼育するのは比較的簡単だが、実験に用いるハエを育てるときは上手に育てる必要がある。以下に上手に育てるためのコツを紹介する。実験を成功させるには、適切な量の卵を確実に採ることが必要である。
1.羽化当日の雌ハエは未成熟であまり産卵しない。羽化後2日間以上たったハエを用いて産卵させる。
2.エサビン1ビンに20頭程度の雌と10-20頭程度の雄を入れて産卵させる。雌の数が少ないと産卵数が少なくて実験に支障をきたすかもしれない。頭数は正確でなくてよいが雌雄合計40頭程度が適切である。
3.確実に産卵させるためには、練り酵母を入れたエサビンに産卵させる。このエサビン中で二晩から三晩産卵させ、親ハエは捨てる、または、新しいエサビンに移す。
4.産卵数があまりにも多いと発生中にエサ不足になり発生が遅れる。練り酵母を入れて25℃で飼育するとエサ替え後6-7日目に蛹になるが、過密だとこれが10-12日間以上もかかることがある。産卵状態を確認し、十分な産卵があるときはハエを取り除き、それ以上産卵させないことが重要である。
*過密だとエサ不足になり幼虫期の期間が長くなる。幼虫は一定体重に成長してから蛹化過程に入るという性質があるからである。しかし、蛹期は高密度で育っても低密度で育っても発生速度は変わらない。
5.産卵数を増やすためにハエを多く入れすぎると失敗することがある。ハエがエサにくっつき、かえって産卵数が減少したり、エサが汚れたりする。
【雄ハエと雌ハエの区別のしかた】
雄ハエと雌ハエの選別は、ハエを麻酔で動かなくし、実体顕微鏡下でハエを見ながら行う。雄ハエと雌ハエは腹部末端部の形態に違いがある。
①ハエを腹側から見ると、雌の腹部末端部は比較的単純な構造だが、雄には茶色で複雑な構造の交尾器がある。この違いは羽化直後からはっきりしている。
②ハエを背側から見ると、雌には腹部末端側3体節のそれぞれに黒縞模様があるが、雄では腹部末端側3体節の黒縞模様が合体して1つづきの大きな黒模様となっている。ただし、羽化直後(1時間くらいまで)のハエは腹部全体が白く黒縞模様は見えない。黒縞模様は羽化後次第に出てくる。したがって、羽化直後は黒縞模様の違いで雌雄の区別はできない。
【練り酵母入り餌ビンの作り方】(図5G1-G2)
【材料・器具】小型ビーカーまたはプラスチック遠沈管(理化学器具、50ml)、小型薬さじ(理化学器具、スパチュラ型)、パン酵母(食品材料)
1.パン酵母を蒸留水で溶いて(0.5g乾燥パン酵母に水0.65mℓ)練り歯磨き程度のやわらかさの練り酵母を作る。
2.小型薬さじまたはガラス棒で練り酵母をすくいとり、エサの表面につける。
3.エサビンの蓋をして一晩おいて表面を乾かしてからハエの飼育に使用する。練り酵母入りエサビンは室温で数日間保存可。*簡易的には、ハエを移す直前にエサビンに少量(小型薬さじ一さじ)の乾燥パン酵母を入れるだけでも効果がある。
4.練り酵母は4℃保存。保存中にハエが入ってこないように蓋を確実にする。
7.ビン洗い・栓洗い
使用済みのハエビンはハエを確実に殺してからビンを洗い、再利用する。ハエの成虫と幼虫が死んでいることを必ず確認する。使用済みのハエビンは速やかに洗う。使用済みのハエビンを長く放置するとダニが増えることがある。
【器具】電子レンジ(一般機器、単機能)、ブラシ(一般器具、35-37mmφ)、洗剤(一般物質、中性洗剤)、ザル・桶(一般器具)、薬さじ(理化学器具、培養用試験管の口径に合わせて加工する)
【手順】
①移し終えた使用済みハエビンは電子レンジで1回沸騰するまで熱してハエを殺す。電子レンジがない場合は、40℃以上のお湯に60分間以上いれて殺してもよい。確実に殺すことが重要。
②栓を取り、ビンのなかみを薬さじでかき出して捨てる。
*使用済みエサとハエの死体は通常の家庭ごみの可燃性廃棄物で捨てることができる。③中身をかき出したビンを湯に浸しよごれを落ちやすくする。その後、流水をかけながらビン内をブラシ(図7D)できれいに洗う。
④ビンを逆さにして風乾する。ガラスビンの場合は乾熱滅菌器で120℃1時間で滅菌する。
⑤スポンジ栓は湯につけてしばらく置いた後、洗剤でもみ洗いする。
⑥その後、スポンジ栓は強くしぼって(あるいは洗濯器で)脱水し、ざるに入れて一晩おくか、食器乾燥機に入れて乾燥する。
8.麻酔のかけ方
ショウジョウバエの計数や、雄雌の選別、特定の表現型ハエの採取は、ハエに麻酔をかけて動かなくしてから行う。麻酔はエーテルガスで行う。ショウジョウバエに麻酔をかける方法は、エーテル麻酔のほかに炭酸ガス麻酔、冷麻酔があるが、生徒理科研究では簡単で長持ちするエーテル麻酔がよい。エーテルガス中にハエを入れ、ハエが動かなくなり、顕微鏡で観察すると後足だけをピクピクと動かしている状態になれば、麻酔がかかった状態である。あまり長くエーテルにさらすとハエは死んでしまうので、麻酔はハエの状態を観察しながら行う。*大学研究室では毒性がより少なく麻酔コントロールが容易な炭酸ガス麻酔を用いる。
【器具・薬品】ジエチルエーテル(薬品)、麻酔ビン(自作)、小型ロート(理化学器具、ポリプロピレン製、φ55㎜)、白タイル(一般器具、10cmx10cm、または木板)、スポンジクッションマット(一般器具)、パスツールピペット(理化学器具、外径約7mm)、ゴム管(理化学器具または工作器具、パスツールピペットに合う径、長さ約50cm)、小型絵筆(文具、毛幅1mm、長さ5mm)、中型絵筆(文具、毛幅10mm、長さ15mm)、先細ピンセット(先端の幅0.3mm以下。先端がピッタリあうように油砥石で研いで用いる)
【麻酔ビンと麻酔ロートの作製】(図5)
1.プラスチック遠沈管(平底)を高さ6cmの位置で切断し(図5H1)、底側を麻酔ビンとする。切断は金鋸でおこない、切断口のヘリをやすりで削り平らにする。
2.小型ロートの出口側の管の長さを25mmの長さに切断する(図5H1)。
3.小型ロートの出口側の管の周囲に脱油綿を巻き、輪ゴムでしっかり留めて麻酔ロートとする(図5H1)。
4.麻酔ロートの脱脂綿にエーテルを200~500μℓ浸み込ませ、麻酔ビン上にのせてハエの麻酔に使用する(図5H2,図5I1)。
【麻酔の手順
①麻酔ビンの底にハエが入っていないこと、麻酔ロートの脱脂綿にハエが引っかかっていないことを確認する。
②麻酔ロートの脱脂綿にエーテルを200~500μℓ浸み込ませ、麻酔ビン上にのせてエーテルガスを充満させる(図5I1)。
③麻酔ロートにハエビンを逆さにしてつなぎ、麻酔ビンごとクッションマットに軽く打ちつけてハエを麻酔ビンにはたき落とす(図5I2)。
④ハエが麻酔により動かなくなるまで待つ(30秒-1分間程度)。後足をピクピクと動かしていてもよい。麻酔の継続時間はエーテルガスの濃度と処理時間による。エーテル処理時間が長いほど麻酔が長くもち、短いと麻酔から早く覚める。かなり強くかけても死ぬことは少ない。しかし処理時間が長すぎるとハエは死ぬ。死ぬと翅を挙げたままになるので分かる。
⑤ハエを麻酔ビンから木板(または白タイル)上に移し(図5I3)、実態顕微鏡下で性別や表現型で選別したり計数したりする。ハエの取り扱いは、小型絵筆を用いて行う(図5I4)。動き出したら再び麻酔ビンに戻して麻酔をかける。作業時間の長さにより麻酔の強さを調節する。
⑥麻酔をかけたハエをエサビンに入れるときは、ロートをエサビンの上にのせて入れる。ハエを戻したら栓をする。大量のハエを同時に扱うときは中型絵筆(図5D)を用いる。
⑦栓をした後、ビンを逆さにしてハエを栓の位置まで移動させてから、エサビンを寝かして麻酔が冷めるまで置く。麻酔が覚めハエが動き出すようになってからエサビンを立てる。麻酔のかかったハエをエサ上に長時間置くとハエがエサにくっつくことがあるので注意する。
⑧不要になったハエはハエ捨てビン(図5B)に捨てる。
*ハエの詳細な形態観察は、長時間エーテル麻酔を行ってハエを殺してから行う。
【少数のハエの麻酔】
少数のハエを取り出し麻酔をかける時は、吸虫管でハエをとらえ麻酔ビンに入れて麻酔を行う。
1.吸虫管のつくり方:吸虫管はガラス管でできたハエ吸い込み部と口付け部をゴム管でつないだ構造である(図5J)。ハエ吸い込み部は、小型のパスツールピペットの先端を適当な太さ(ハエが1頭入る程度の切口)の位置でやすりを用いて切断し、切口をガスバーナーであぶり滑らかにしてつくる。この基部側に綿球を入れる。口付け部は、別のパスツールピペットの基部側5cmをやすりで切断し、切口をガスバーナーであぶりなめらかにしてつくる。2つのガラス管を50cmのゴム管でつなぐ。
2.ハエのとらえ方:口付け部を口にくわえ、ハエ吸い込み部をハエビンのスポンジ栓のよこから差し込み、先端をハエに向けて空気を軽く吸い込むことでハエをとらえる。このとき、吸い込む空気は口の中までだけ吸い、肺までは吸い込まない。
3.捕えたハエは、エーテルガスを充満させた麻酔ビン中に吹き入れる。その他の処理は、上記一般麻酔と同じ。
9.実験器具・薬品の購入
実験機器・薬品の選定・購入先は生徒の理科研究所ホームページ「関連情報」ページの「理化学機器・薬品等のカタログ・購入方法」にまとめられている。
10.ハエの飼育と麻酔に関する小研究テーマ
下記の各実験の結論はハエを用いて研究を行う者にとっては実験の過程で自然に理解し身に付けるものである。しかし、ハエを初めて飼って実験を行おうとする高校生には、あらためて研究として行うこともハエの理解と研究方法の習得のためには良い方法だろう。
①ハエの飼育温度と発生(成長)速度の関係を明らかにする実験を計画・実行し、どのような関係があるのか明らかにせよ。(産卵から蛹化までの日にち、および産卵から羽化までの日にちを測定する)
②産卵数が発生速度にどのような影響を与えるのかを明らかにする実験を計画・実行し、どのような関係があるのか明らかにせよ。(産卵から蛹化までの日にちおよび産卵から羽化までの日にちと、ハエの数の関係を明らかにする)
③羽化後の時間(日にち)によって交尾・産卵にどのような差があるのかを、雌の場合、雄の場合それぞれについて明らかにする実験を計画し実行せよ。
④練り酵母が産卵を促進することを示す実験を計画し実行せよ。
⑤「ハエの麻酔の強さはエーテルガス濃度と処理時間に依存する」ことを示す実験を計画し実行せよ。
⑥「ハエの羽化後の日数により麻酔のかかりやすさに差があるか否か」「雄と雌で麻酔のかかりやすさに差があるか否か」の問いに答えるための実験を計画し実行せよ。
⑦「麻酔から覚めるまでの時間は、温度や外部刺激によって異なるか否か」の問いに答えるための実験を計画し実行せよ。
⑧冷麻酔の効果を示す実験を計画し実行せよ。
その他、ハエの飼育と麻酔に関係する実験計画を作成し実行せよ。
おわりに
これまでに発表された中学・高校教育のためのショウジョバエ飼育法(前川, 1999; Akasaka; 宮内; 布山; Jfly discussion)は、大学の専門研究室の飼育法と比べて、安定した系統維持という点でも効率的・実戦的飼育という点でも生物機能の研究には不十分である。そこで本論文では、大学研究室の方法(辻村・赤川, 2014; Sullivan 他, 2000)をもとに現実の高校現場を考慮しつつ開発した生徒理科研究のためのショウジョウバエ飼育法と麻酔法を紹介した。また、研究を進める中で遭遇する諸問題を解決するためのノウハウを紹介した。本論文で紹介した方法は、さまざまな生物機能に関するショウジョウバエを用いた生徒理科研究の展開に貢献するに違いない。
ここで紹介した飼育方法やノウハウはショウジョウバエ研究を行う大学研究室では当たり前のことで、特別のものはない。しかし、その内容の公開は生徒理科研究の発展には重要な意味を持つ。一般に、大学の研究室では研究テーマに沿ったさまざまなノウハウが開発・蓄積され、これらノウハウが研究の推進に重要な役割を果たしている。このノウハウなしには研究の推進は不可能である。しかし、これらノウハウは、一部が実験方法書として英語等で出版・公開されることがあっても、(ショウジョウバエ分野は他分野に比べて比較的多くの実験書が出版公開されている)、多くは公開されることはない。それを知るには、それぞれの研究室に大学院学生としてあるいは研究員として所属し、その研究に参加する以外に方法はない。ここに、生徒理科研究の大きな困難がある。ある分野の研究に生徒が興味をもち取り組もうとしても、その学校が部活等で長年その分野の研究に取り組みノウハウを蓄積していない限り、教育を主な任務とする高校にはその研究に必要なノウハウがないのが普通である。また一方、大学で開発されたノウハウが研究環境の違う高校現場ではそのままでは通用せず、一定の修正が必要な場合もある。この問題の解決には高校・大学両者の協力した取り組みと、その成果(生徒研究用ノウハウ)の公表が必要だが、本論文はそうした取り組みの1つである。
最後に、ショウジョウバエ研究の理解に役立つ大学レベルの入門書として、「ネオ生物学シリーズ ゲノムから見た新しい生物像 昆虫」(西田,1996)を、専門実験方法書として、「Drosophila Protocols」(Sullivan 他,2000)を紹介する。
謝辞
都丸雅敏博士(京都工芸繊維大学)に対し、必要な薬品の入手に便宜を図っていただいたことに感謝する。京都工芸繊維大学ショウジョウバエ遺伝資源部門京都ストックセンターに対し、ショウジョウバエ系統を分与していただいたことに感謝する。
研究費補助金
普後・辻村に対するJSPS科学研究費(研究課題番号JP23300281,研究代表者 普後一)の助成、および、森中に対するSSH事業実施経費(指定校 大阪教育大学附属高校天王寺校舎)の助成を受けた。
役割分担
辻村・赤川・普後:大学におけるショウジョウバエ飼育・麻酔実験と論文執筆。
城・谷本・森中:高校におけるショウジョウバエ飼育・麻酔実験と問題点の把握。
利益相反
利益相反なし。
引用文献
Akasaka,M.: 遺伝(2) ハエの飼育の準備,雌雄の区別など、MAkasaka's HomePage、http://www. makasaka.net/seibutu/iden2/iden2.html、2019/10 /31.
相垣敏郎(2016):ショウジョウバエの寿命を制御する栄養と代謝、基礎老化研究 40(2):15-18.
布山喜章:「ショウジョウバエ実験法(入門編・初級編)」、東京都立大学ホームページ(首都大学東京理工学研究科生命科学専攻 進化遺伝学研究室・細胞遺伝学研究室)、http://www.biol.se.tmu.ac.Jp /fly/method-intro.html、 2019/10/31.
千原崇裕・三浦政幸(2014): 老いた個体の行動を左右する嗅覚神経の細胞死―老化にともなう神経細胞死と個体行動の関係―、東京大学ホームページ(東京大学PRESS RELEASES)、https://www.u-tokyo.ac.jp/focus/ja/press/p01_260627.html、2019/10 /31.
ゲーリング,ワルター・J (2002) : ホメオボックス・ストーリー 形づくりの遺伝子と発生・進化、浅島誠(監修)、東京大学出版会.
伊藤啓(2017): 昆虫の体性感覚神経回路の構造を解明―哺乳類との高い類似性を発見。脳が共通の祖先から進化した可能性が高まる―、日本医療研究開発機構ホームページ(プレスリリース)、 https://www.amed.go.jp/news/release_20171103.html、 2019/10/31.
Jfly discussion (1995) :インスタントのハエのエサ + 高校向けの生物実験解説書、Jflyホームページ、http://jfly.uni-koeln.de/html/discussion/1995/9510_instant_fly_food.html、2019/10/30.
上川内あずさ(2014):ショウジョウバエの行動分子遺伝学、動物行動の分子生物学、久保健雄・奥 山輝大・上川内あずさ・竹内秀明、裳華房.
倉田祥一郎(2014):ショウジョウバエを用いた自然免疫に作用する化合物の探索、 生化学 86(5):583-587.
前川洋(1999):ショウジョウバエ簡易培地、北海道立理科教育センター研究紀要 11:65-66.
松野健治:ショウジョウバエにおける左右非対称性の形成機構、大阪大学大学院理学研究科生物科学専攻ホームページ(細胞生物学・松野研究室)、http://www.bio.sci.osaka-u.ac.jp/bio_web/lab_page/matsuno/project.html、2019/10/31.
松本幸久・佐藤千尋(2009): 昆虫の記憶関連分子:ショウジョバエの学習・記憶変異体の研究から、比較生理生化学 26(1):12-22.
三井洋司・樋口京一・森政之・石井直明・重本和宏・木村展之(2014): 老化の生物モデルを縦横に切り、考える! 基礎老化研究 38(3):43-49.
三浦政幸 (2012):プログラム細胞死:その分子機序と発生における生理的な役割、領域融合レビュー 1:e002.
宮内花乃子:ショウジョウバエ飼育法、鹿児島大学教育学部ホームページ(動物ホーム)、
http://www.edu.kagoshima-u.ac.jp/science/st-sci/animal/zenki/syoujoubae.htm、2019/10/31.
中西貴幸 (2017) : サーカディアンリズムをコントロールする分子メカニズムの発見、日教弘ライフサポート倶楽部ホームページ(子供たちに聞かせてあげたいノーベル賞2017)、https://www.nikkyoko.net/common/download/2017/medical2017.pdf.
中西貴幸 (2011) : 自然免疫に関する発見 獲得免疫における樹状細胞とその役割の発見、日教弘ライフサポート倶楽部ホームページ(子供たちに聞かせてあげたいノーベル賞2011)、 https://www.nikkyoko.net/common/download/2011/medical2011.pdf.
鍋島陽一(1998): 個体老化研究のあらたな展開:老化関連遺伝子見つかる、細胞工学17(1):16-19.
西田育功(編)(1996):昆虫―超能力の秘密― ネオ生物学シリーズ―ゲノムから見た新しい生物像―、共立出版.
能瀬聡直 (1996):神経系の形成にかかわる遺伝子、 ネオ生物学シリーズ ゲノムから見た新しい生物像 昆虫、西田育功(編)、共立出版.
岡田益吉 (1996) : 1995年度ノーベル医学生理学賞受賞によせて Nusslein-Volhard博士,Wieshaus博士,Lewis博士―現代発生学の幕を開けた3人―、蛋白質核酸酵素 41(2):178-181.
Sullivan,W., M.Ashburner, R.S.Hawley (2000) : Drosophila Protocols, Cold Spring Harbor Labo-ratory Press.
谷口喜一郎・井垣達吏(2017): 細胞競合の分子機構とその生理的な意義、領域融合レビュー 6:e008.
谷村禎一(1996): 行動の遺伝子、「ネオ生物学シリーズ ゲノムから見た新しい生物像 昆虫」西田育功(編)、共立出版.
辻村秀信・赤川裕美 (2014) : ショウジョウバエの飼育法と取り扱い方、理科教師のための昆虫生命科学―地球は虫の惑星だ! 普後一(編著)、文部科学省科学研究費補助金成果報告書.
山口政光(2016): ヒト希少神経難病にショウジョバエで挑む、生物工学会誌 94(8): 514-517.
山元大輔(2012): 遺伝子と性行動―性差の生物学―、裳華房.
(英文)表題・著者名・要旨
Seitonorika 2019-1
Methods for high school student research on a fruit fly, Drosophila melanogaster. 1. Rearing and anesthetizing flies for experimental studies
Tsujimura Hidenobu, Akagawa Hiromi, Jo Asuka, Tanimoto Sakuya, Morinaka Toshiyuki, Fugo Hajime
We describe here how to rear and anesthetize flies for experimental studies in high school student research. 1. Getting fly strains. 2. Preparing food vials. 3. Transferring flies into new food vials. 4. Growing flies for experimental usage. 5. Washing and cleaning used food vials. 6. Environmental control for rearing flies. 7. Tips to grow flies well. 8. Anesthetizing flies. 9. Purchasing experimental apparatus and chemicals. 10. Small research projects on fly rearing and anesthetizing. This paper will enable to stably keep fly strains and effectively and efficiently rear flies in high school student research.


